Anúncios
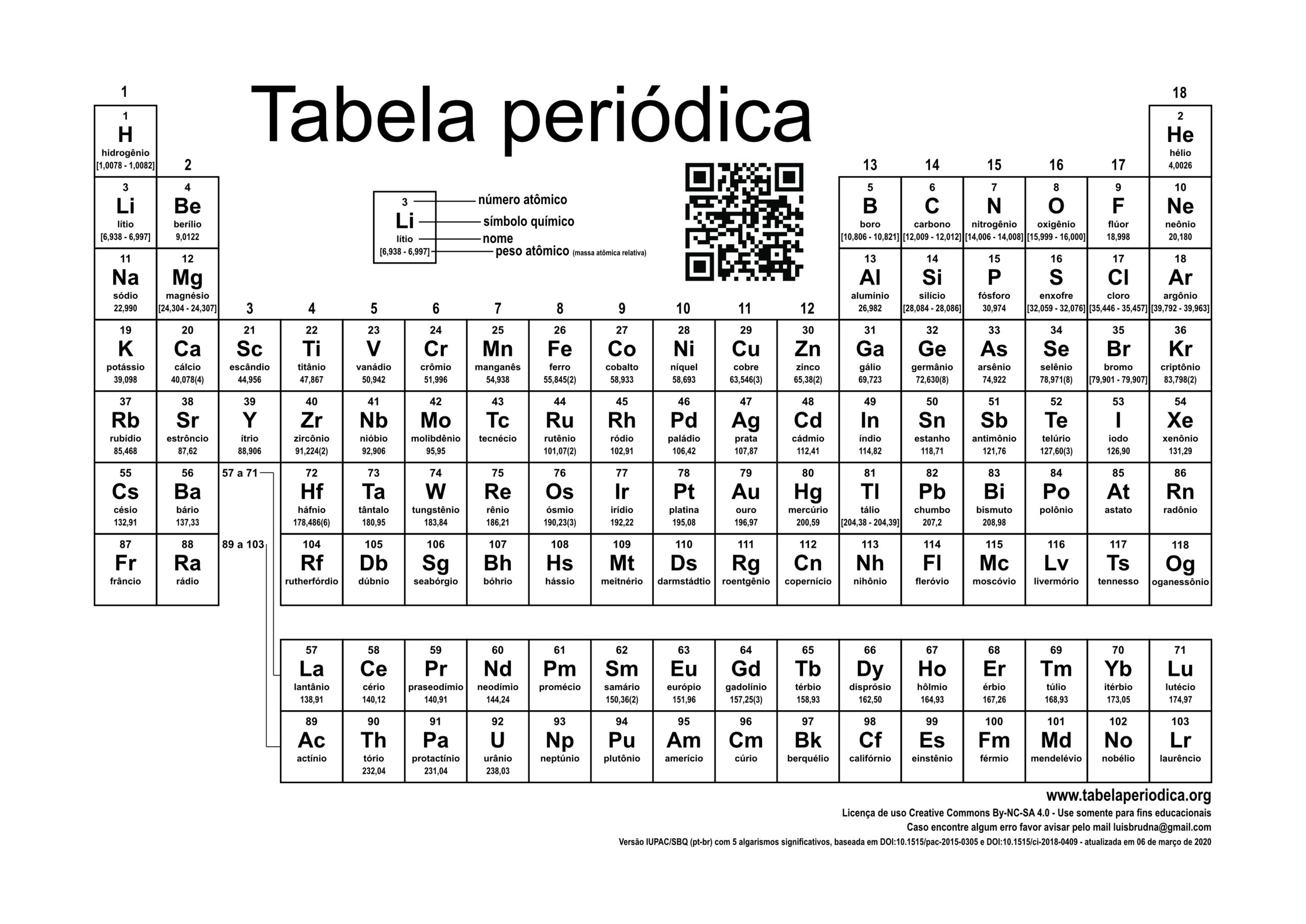
A Tabela Periódica é um modelo que agrupa todos os elementos químicos conhecidos e suas propriedades. Eles estão organizados em ordem crescente de números atômicos (número de prótons).
No total, a nova Tabela Periódica possui 118 elementos químicos (92 naturais e 26 artificiais).
Cada quadrado especifica o nome do elemento químico, seu símbolo e seu número atômico.
Organização da Tabela Periódica
Os chamados Períodos são as linhas horizontais numeradas, que possuem elementos que apresentam o mesmo número de camadas eletrônicas, totalizando sete períodos.
- 1º Período: 2 elementos
- 2º Período: 8 elementos
- 3º Período: 8 elementos
- 4º Período: 18 elementos
- 5º Período: 18 elementos
- 6º Período: 32 elementos
- 7º Período: 32 elementos
Com a organização dos períodos da tabela algumas linhas horizontais se tornariam muito extensas, por isso é comum representar a série dos lantanídeos e a série dos actinídios à parte dos demais.
As Famílias ou Grupos são as colunas verticais, onde os elementos possuem o mesmo número de elétrons na camada mais externa, ou seja, na camada de valência. Muitos elementos destes grupos estão relacionados de acordo com suas propriedades químicas.
Anúncios
São dezoito Grupos (A e B), sendo que as famílias mais conhecidas são do Grupo A, também chamados de elementos representativos:
- Família 1A: Metais Alcalinos (lítio, sódio, potássio, rubídio, césio e frâncio).
- Família 2A: Metais Alcalino-Terrosos (berílio, magnésio, cálcio, estrôncio, bário e rádio).
- Família 3A: Família do Boro (boro, alumínio, gálio, índio, tálio e unúntrio).
- Família 4A: Família do Carbono (carbono, silício, germânio, estanho, chumbo e fleróvio).
- Família 5A: Família do Nitrogênio (nitrogênio, fósforo, arsênio, antimônio, bismuto e ununpêntio).
- Família 6A: Calcogênios (oxigênio, enxofre, selênio, telúrio, polônio, livermório).
- Família 7A: Halogênios (flúor, cloro, bromo, iodo, astato e ununséptio).
- Família 8A: Gases Nobres (hélio, neônio, argônio, criptônio, xenônio, radônio e ununóctio).
Os elementos de transição, também chamados de metais de transição, representam as 8 famílias do Grupo B:
- Família 1B: cobre, prata, ouro e roentgênio.
- Família 2B: zinco, cádmio, mercúrio e copernício.
- Família 3B: escândio, ítrio e sério de lantanídeos (15 elementos) e actinídeos (15 elementos).
- Família 4B: titânio, zircônio, háfnio e rutherfórdio.
- Família 5B: vanádio, nióbio, tântalo e dúbnio.
- Família 6B: cromo, molibdênio, tungstênio e seabórgio.
- Família 7B: manganês, tecnécio, rênio e bóhrio.
- Família 8B: ferro, rutênio, ósmio, hássio, cobalto, ródio, irídio, meitnério, níquel, paládio, platina, darmstádio.
Por determinação da União Internacional de Química Pura e Aplicada (IUPAC), os grupos passaram a ser organizados por números de 1 a 18, embora ainda seja comum encontrarmos as famílias sendo descritas por letras e números como mostrado anteriormente.
Uma importante diferença que o novo sistema apresentado pela IUPAC gerou é que a família 8B corresponde aos grupos 8, 9 e 10 na tabela periódica.
Tabela Periódica preto e branco
História da Tabela Periódica
A finalidade fundamental de se criar uma tabela era facilitar a classificação, a organização e o agrupamento dos elementos conforme suas propriedades.
Até se chegar ao modelo atual, muitos cientistas criaram tabelas que pudessem demonstrar uma forma de organizar os elementos químicos.
A Tabela Periódica mais completa foi elaborada pelo químico russo Dmitri Mendeleiev (1834-1907), no ano de 1869 em função da massa atômica dos elementos.
Mendeleiev organizou grupos de elementos de acordo com as propriedades semelhantes e deixou espaços vazios para os elementos que ele acreditava que ainda seriam descobertos.
A Tabela Periódica como a conhecemos atualmente foi organizada por Henry Moseley, em 1913, por ordem de número atômico dos elementos químicos, reorganizando a tabela proposta por Mendeleiev.
William Ramsay descobriu os elementos neônio, argônio, criptônio e xenônio. Esses elementos juntamente com hélio e radônio incluíram a família dos gases nobres na Tabela Periódica.
Glenn Seaborg descobriu os elementos transurânicos (do número 94 ao 102) e em 1944 propôs a reconfiguração da Tabela Periódica, colocando a série dos actinídios abaixo da série dos lantanídios.
Em 2019, a tabela periódica completa 150 anos e foi criada uma resolução das Nações Unidas e da UNESCO para que esse seja o Ano Internacional da Tabela Periódica dos Elementos Químicos como forma de reconhecimento de uma das criações mais influentes e importantes da ciência.
Curiosidades da Tabela Periódica
- A União Internacional de Química Pura e Aplicada (em inglês: International Union of Pure and Applied Chemistry – IUPAC) é uma ONG (Organização não governamental) dedicada aos estudos e avanços da Química. Mundialmente, o padrão estabelecido para a Tabela Periódica é recomendado pela Organização.
- Há 350 anos atrás, o primeiro elemento químico isolado em laboratório foi o fósforo pelo alquimista alemão Henning Brand.
- O Elemento Plutônio foi descoberto na década de 40, pelo químico estadunidense Glenn Seaborg. Ele descobriu todos os elementos transurânicos e ganhou o Prêmio Nobel em 1951. O elemento 106 recebeu o nome Seabórgio em sua homenagem.
- Em 2016, novos elementos químicos da tabela foram oficializados: Tennessine (Ununséptio), Nihonium (Ununtrio), Moscovium (Ununpêntio) e Oganesson (Ununóctio).
- Os novos elementos químicos sintetizados são chamados de superpesados por conterem em seus núcleos um número elevado de prótons, que vem a ser muito superior aos elementos químicos encontrados na natureza.